近日,国际学术期刊Molecular Plant在线发表了我校李霞教授完成的题为“Counteraction of ABA-Mediated Inhibition of Seed Germination and Seedling Establishment by ABA Signaling Terminator in Arabidopsis”的研究论文。
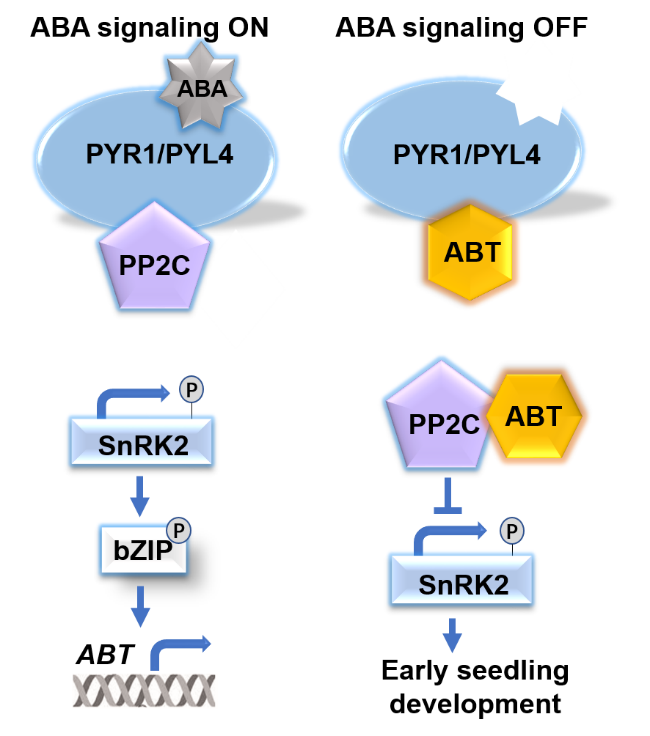
图1. ABT通过关闭ABA信号调控种子萌发和幼苗生长的分子模型
种子的萌发是新生命的起始。萌发要在适宜的条件下进行,不良的环境,比如干旱、盐或者冷会抑制萌发,在这个过程中ABA发挥重要的作用。环境胁迫会诱导植物体内产生大量的ABA,ABA和PYR1/PYLs受体结合启动ABA信号转导,ABA-PYR1/PYLs受体复合物与PP2C类磷酸酶结合,从而释放在静息状态下被PP2C 抑制的激酶SnRK2s(SnRK2.2, SnRK2.3和SnRK2.6)。SnRK2s被激活后磷酸化下游的bZIP类的转录因子,包括ABI5, ABF1, ABF2等,从而激活下游的报告基因,响应生长和环境胁迫。
ABA信号激活有助于植物对环境胁迫做出响应,有利于其在不良的条件下存活。但是ABA过度激活也不利于植物从逆境中恢复,因此对植物来说,如何终止ABA信号也是一个很重要的问题。以前的研究发现对ABA信号通路组分修饰有助于ABA终止,比如,PYR1/PYLs受体和SnRK2s的蛋白质降解能够终止ABA信号,PYR1/PYLs和磷酸化修饰或者SnRK2s的硝基化修饰也可以钝化ABA信号。我校李霞团队研究发现拟南芥中一个WD40蛋白ABT(ABA Terminator)在关闭ABA信号通路中发挥关键作用。ABT表达受ABA高度诱导,而在ABA受体,PP2C获得型突变体(abi1-1和abi2-1)以及snrk2s突变体中,ABA诱导的ABT表达被降低,说明ABT表达依赖于ABA信号通路核心组分。ABT缺失突变体在萌发和转绿中对ABA敏感,而过表达突变体则对ABA不敏感,证明ABT是ABA信号通路中一个负调控因子。WD40结构域介导蛋白质-蛋白质之间的相互作用,ABT中含有7个WD40结构域,说明ABT可能通过蛋白质互作调节ABA信号,实验结果也证明确实如此。用ABT做诱饵蛋白进行酵母双杂交筛选,得到60个可能的互作蛋白,其中包括ABA受体PYL4,PP2C蛋白ABI1, ABI2和AHG3,进一步研究证明ABT与多个PYR1/PYLs和PP2C蛋白互作。PYR1/PYLs和PP2C蛋白结合是激活ABA信号通路的首要步骤,因此我们分析了ABT对PYR1/PYLs和PP2C蛋白互作的影响。Pull-down,酵母三杂交以及BiFC实验证明ABT减弱PYR1/PYL4和ABI1/ABI2的结合,进一步分析表明ABT和ABI1亲和力大于ABI1和PYR1的亲和力,因此在ABT存在条件下,ABI1将优先结合ABT,从而减弱PYR1/PYLs对ABT的抑制。ABI1体外磷酸酶活性分析也证明了这个结果,在ABA和PYR1存在时,ABI1磷酸酶活性大幅下降,而在ABT存在时,ABI1磷酸酶活性下降减少,说明ABT和ABI1结合促进了ABI1磷酸酶活性,从而抑制ABA信号。
综上所述,本研究揭示了一个新的终止ABA信号的新的机制。在没有ABA时,ABT表达量很低,PP2C和SnRK2s结合抑制其活性,ABA处于关闭状态;在有ABA时,ABA与PYR1/PYLs受体结合,改变受体构象,ABA-PYR1/PYLs与PP2C结合后释放SnRK2s,激活ABA信号,启动包括ABT在内的下游基因表达。ABT与PP2C及PYR1/PYLs受体结合,并与PYR1/PYLs受体竞争结合PP2C,从而终止ABA信号。
我校植科院王志娟副教授、博士研究生任仔银、中国科学院遗传发育所农业资源研究中心程春红博士、王涛博士为共同第一作者,植科院李霞教授为通讯作者,中国科学院上海逆境中心朱健康研究员、赵杨研究员、浙江农业科学院邓志平研究员给予该项研究大力支持。该项目获得国家重大研发计划、国家自然科学基金和beat365正版唯一官网必一自主课题支持。
原文链接:https://www.cell.com/molecular-plant/fulltext/S1674-2052(20)30212-4
供稿:王志娟
审核:李霞


